Médicaments en ligne livrés en 24h

Nouveautés
Chez vous demain
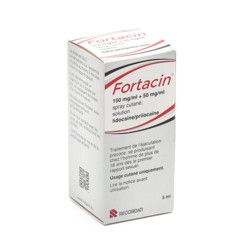
Bouchara Recordati
Fortacin spray pour éjaculateur précoce
Retardant - Lidocaïne + Prilocaïne - Adulte
Contenance
5 ml
39,90 €
Chez vous demain
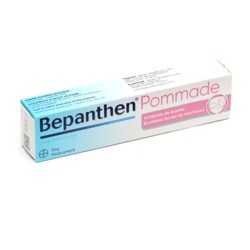
Bepanthen
Bepanthen pommade pour irritation de la peau
Irritations, érythème fessier - Dès la naissance
Contenance
30 g
100 g
100 g + 30 g
2 x 100 g
3 x 100 g
A partir de
5,41 €
5,41 €
Chez vous demain
Sanofi
Allervi antihistaminique Sanofi
Rhinite allergique saisonnière - Dès 12 ans
Contenance
7 comprimés
3,80 €
Chez vous demain

Rennie
Gommes à mâcher Rennaxt 750 mg
Soulage les brûlures d'estomac, la digestion difficile - A partir de 12 ans
Contenance
20 gommes
7,21 €
Chez vous demain

Cooper
Cooper Minoxidil 2% en flacon
Chute de cheveux modérée - Favorise la pousse des cheveux
Contenance
3 x 60 ml
10,49 €
Commandés par nos clients
Chez vous demain
Doliprane
Doliprane Tabs 1000 comprimé
Douleurs et fièvre - Adultes et adolescents >50kg
Contenance
8 comprimés
1,99 €
Chez vous demain

Doliprane
Comprimés de Doliprane 1000 mg
Douleurs et fièvre - Adultes et adolescents >50kg
Contenance
8 comprimés
2,18 €
Chez vous demain
Chez vous demain

Doliprane
Gélules de Doliprane 1000
Douleurs et fièvre - Adultes et adolescents >50kg
Contenance
8 gélules
2,18 €
Chez vous demain
Chez vous demain
Viatris
Creme Econazole mycose
Traitement des mycoses cutanées et génitales - Dès 1 mois
Contenance
30 g
2,74 €
Chez vous demain
Viatris
Comprimés Ibuprofène 400 mg Viatris
Douleurs et fièvre - Adultes et enfants > 30 kg
Contenance
12 comprimés
2,90 €
Chez vous demain
Doliprane
Doliprane 1000 comprimés effervescents
Douleurs et fièvre - Adultes et adolescents >50kg
Contenance
8 comprimés
2,18 €
Chez vous demain

Gaviscon
Médicament Gaviscon en sachet
Brûlures d'estomac, remontées acides - Adulte
Contenance
24 sachets
5,99 €
Chez vous demain
Certains maux du quotidien peuvent faire l’objet d’une automédication via l’achat de médicaments en ligne. Que ce soit lors d’épisodes de fièvres ou de douleurs, de troubles digestifs, urinaires ou de diverses toux qui parasitent notre bien-être, notre pharmacie en ligne s’appuie sur l’expertise de ses pharmaciens pour vous proposer un large choix de médicaments sans ordonnance qui vous soigneront dès les premiers symptômes de manière efficace et fiable. Nous vous recommandons cependant de consulter votre médecin s’ils persistent au-delà de quelques jours. L’automédication et l’achat de médicaments en ligne, via notre service sécurisé, n’a jamais été aussi simple et sûre.
Enfin, et ce, afin de garantir votre satisfaction et de vous fournir une expérience client efficace et fiable, notre pharmacie en ligne répond également aux exigences de la certification qualité ISO 9001. Outre les conseils de pharmaciens en ligne, nous proposons, également, sur notre site internet de nombreuses fiches conseils destinées à vous aider dans votre choix de produits, des conseils de prévention santé ainsi que des articles d'actualité santé sur notre blog.
Se soigner en achetant des médicaments sans ordonnance
Par définition, un médicament est une substance ou une composition chimique dotée de pouvoirs curatifs ou apaisants en fonction de leur formule. Ils sont le plus souvent prescrits sur ordonnance suite au diagnostic d’un professionnel de la santé selon une posologie adaptée à la maladie et au patient. Toutefois, certains médicaments sans ordonnance, ceux-là même que nous vendons en ligne, sont destinés à l’automédication et ne nécessitent pas de prescription médicale. Ainsi, en cas de gorge irritée, de nez qui coule, de mal de tête, de ballonnements, de courbatures, de fièvre, mais aussi de troubles urinaires telles que la cystite ou les problèmes de prostate. Retrouvez des médicaments en ligne sous forme de comprimés, gélules, sachets effervescents, ampoules qui soulageront les premiers signes de ces pathologies bénignes. Agréée par l’Agence Régionale de Santé, notre pharmacie en ligne sélectionne tous ses médicaments sans ordonnance en collaboration avec les laboratoires dans le respect d’un contrôle drastique afin de vous offrir les principes actifs les plus efficaces et les plus fiables.Automédication et conseils de pharmaciens
L’expertise de nos pharmaciens vous accompagne tout au long du processus d’achat de médicaments en ligne depuis le conseil par téléphone si nécessaire jusqu’à la vérification que votre commande est en adéquation avec vos besoins, grâce à un questionnaire interactif qui vous invite à renseigner vos éventuels traitements en cours ou antécédents médicaux. Nous vous rappelons, à ce propos, qu’il est primordial de bien lire la notice du médicament en question, de respecter strictement sa posologie et de vérifier sa date de péremption afin de se prémunir d'événtuels risques sanitaires. D’autre part, la prise de différents médicaments simultanément, en dehors de toute recommandation préalable, peut s’avérer très dangereuse dans le cadre d’une automédication. C’est la raison pour laquelle, nos pharmaciens prennent le soin de contrôler l’ensemble de votre commande afin d’en vérifier la compatibilité et de vous alerter au cas où elle ne serait pas conforme.Enfin, et ce, afin de garantir votre satisfaction et de vous fournir une expérience client efficace et fiable, notre pharmacie en ligne répond également aux exigences de la certification qualité ISO 9001. Outre les conseils de pharmaciens en ligne, nous proposons, également, sur notre site internet de nombreuses fiches conseils destinées à vous aider dans votre choix de produits, des conseils de prévention santé ainsi que des articles d'actualité santé sur notre blog.